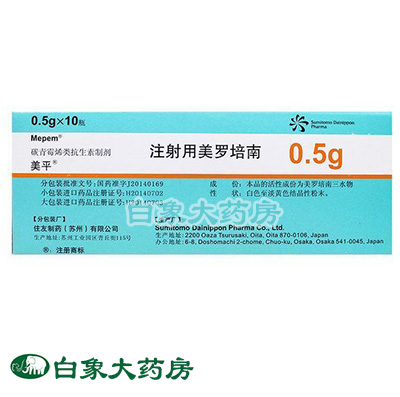
注射用美罗培南(美平)
产品名称:注射用美罗培南 (美平)
包装规格:0.5g*10瓶 产品剂型:注射剂 包装单位:盒
批准文号:国药准字J20140169
生产厂家:日本Sumitomo Dainippon Pharma Co.,Ltd. Oita Plant 分包装:住友制药(苏州)
药品名称:
【通用名称】 注射用美罗培南
【商品名称】 美平 Mepem
【英文名称】 Meropenem for Injection
【汉语拼音】 Zhu She Yong Mei Luo Pei Nan
成份:
化学名称:(4R,5S,6S)-3-[[3S,5S)-5-(Dimethylcarbamoyl)pyrrolidin-3-ylsulfanyl]thio]-6-[(1R)-1-hydroxy-ethyl]-4-methyl-7-oxo-1-azabicyclo[3.2.0]hept-2-ene-2-carboxylic acid trihydrate
分子式:C17H25N3O5S·3H2O
分子量:437.51
辅料:无水碳酸钠
性状:
白色~淡黄色粉末状结晶,无味,稍难溶于水,几乎不溶于乙醇或乙醚。
适应症:
由单一或多种敏感细菌引起的成人及儿童的下列感染
肺炎及院内获得性肺炎
尿路感染
腹腔内感染
妇科感染(例如子宫内膜炎)
皮肤及软组织感染
脑膜炎
败血症
对于被推断患有感染的伴中性粒细胞减低的发热病人(成人),可用美平?作为单方经验性治疗或联合应用抗病毒或抗真菌药物治疗。
已经证实,单独应用美平?或联合应用其它抗微生物制剂治疗多重感染有效。目前,尚缺乏在患有中性粒细胞减低或原发/继发免疫功能缺陷的儿科患者中应用本药的经验。
规格:
0.25g(效价)/ 瓶;0.5g(效价)/ 瓶。
用法用量:
成人剂量:
治疗的剂量和疗程需根据感染的类型和严重程度及病人的情况决定。
推荐每日剂量:治疗肺炎、尿路感染、妇科感染例如子宫内膜炎、皮肤及附属器感染:0.5g/次,每8小时一次;治疗院内获得性肺炎、腹膜炎、推定有感染的中性粒细胞减低患者及败血症:1g/次,每8小时一次;
治疗脑膜炎:2g/次,每8小时一次。
对伴有肾功能障碍的成人患者的剂量安排:
对于肌酐清除率小于50ml/min的严重肾功能障碍的患者,应采取减少给药剂量或延长给药间隔等措施,随时观察患者的情况。
对伴肝功能不全的成人患者的剂量安排:
对肝功能不全的患者无需调整剂量。(参考“注意事项”)
老年患者的剂量安排:
对于肾功能正常或肌酐清除率大于等于50ml/min的老年患者无需调整剂量。
儿童剂量:
对于3个月至12岁的儿童,根据所患感染的类型和严重程度、致病菌的敏感程度及患者的状况,推荐剂量为每次10~20mg/kg,每8小时一次。治疗脑膜炎的推荐剂量为每次40mg/kg,每8小时一次。对于体重大于50kg的儿童,按照成人剂量给药。
目前,尚无在肾功能不全的儿童中应用本药的经验。
给药方法:
以100ml以上的液体溶解0.25g~0.5g美罗培南,配制成静脉点滴注射液,可以经15~30分钟静脉点滴给药。
可以和本药配伍的液体:
0.9%氯化钠注射液、5%或10%葡萄糖注射液、5%葡萄糖加0.02%碳酸氢钠注射液、5%葡萄糖生理盐水注射液、5%葡萄糖加0.225%氯化钠注射液、5%葡萄糖加0.15%氯化钾注射液、2.5%或10%甘露醇注射液。
注意:
1. 配制好静脉点滴注射液后应立即使用。使用前,先将溶液振荡摇匀。如有特殊情况需放置,用生理盐水溶解时,室温下应于6小时以内使用,5℃保存时应于24小时以内使用。(本药溶液不可冷冻。)
2. 本药溶解时,溶液呈无色或微黄色透明状液体,颜色的浓淡不影响本药的效果。
不良反应:
调查总例数7925例中,998例(12.6%)出现包括实验室检查值异常在内的不良反应。
主要不良反应为:皮疹41例(0.5%)、腹泻24例(0.3%)、AST(GOT)升高333例(4.2%)、ALT(GPT)升高377例(4.8%)、A1-P升高127例(1.6%)等。另外,以儿童为对象的临床研究中,总病例数755例中,130例(17.2%)出现包括实验室检查值异常在内的不良反应。主要不良反应为:腹泻16例(2.1%),呕吐8例(1.1%),AST(GOT)升高23例(3.1%),ALT(GPT)升高29例(3.8%),血小板增多18例(2.4%),嗜酸性粒细胞增多10例(1.3%)等。
1.严重不良反应
(1)过敏性休克(<0.1%)
注意密切观察,一旦出现不适、口内异常感、喘鸣、眩晕、便意、耳鸣、出汗等症状时,应立即停药并进行适当处理。
(2)急性肾衰等严重肾功能障碍(<0.1%)
定期检查肾功能,密切观察,发现肾功能异常时,应停药并进行适当处理。
(3)伴有血便的重症结肠炎例如假膜性结肠炎等(<0.1%)
密切观察,出现腹痛、频繁腹泻等症状时,应立即停药并进行适当处理。
(4)间质性肺炎、PIE综合征(<0.1%)
密切观察,出现发烧、咳嗽、呼吸困难、胸部X光片异常、嗜酸性粒细胞增多等症状时,应停药并使用肾上腺皮质激素等进行适当处理。
(5)痉挛、意识障碍等中枢神经系统症状(<0 1%)
密切观察,如有上述症状出现时,应立即采取停药措施,在肾功能障碍或中枢神经系统障碍的患者中发生的可能性增加,所以此类病人使用时要特别注意。
(6)中毒性表皮坏死症(Lyell综合征)(<0.1%)、皮肤粘膜眼综合征(Stevens-Johnson 综合征)(频度不明)
密切观察,如有此种症状发生时,应停药并进行适当处理。
(7)全血细胞减少、无粒细胞症、溶血性贫血、(频度不明)、白细胞减少、血小板减少(<0.1%)
定期做血液检查,密切观察,如有异常现象发生时,应停药并进行适当处理。
(8)肝功能障碍(0.1~5%)、黄疸(<0.1%)
定期做肝功能检查,密切观察,如有异常现象发生时,应停药并进行适当处理。
2.严重不良反应(同类药品)
血栓性静脉炎
在使用其它碳青霉烯类抗生素时,偶有发生血栓性静脉炎,应密切观察,如有异常发生时,应停药并进行适当处理。
禁忌:
不得用于下列病人。
1.对本药成分及其它碳青霉烯类抗生素有过敏史的病人。
2.使用丙戊酸钠的病人(参考“药物相互作用”)。
注意事项:
1.一般注意事项
(1)一些临床和实验室证明,美罗培南与其它碳青霉烯类和β-内酰胺类抗菌素、青霉索和头孢菌素有局部交叉过敏反应。已有报告,大多数β-内酰胺类抗菌素可引起严重的反应(包括过敏性反应)。因此,在使用本药前,应详细询问病人过去对β-内酰胺类的抗菌索的过敏史。若对本药有过敏反应,应立即停药并作相应处理。
(2)严重肾功能障碍的病人,参考“用法用量”、“药代动力学”。
(3)严重肝功能障碍的病人,有可能加重肝功能障碍。
(4)老年人,参考“老年患者用药”。
(5)进食不良的病人或非经口营养的病人、全身状况不良的病人,有可能引起维生素K缺乏症状。
(6)有癫痫史或中枢神经系统功能障碍的患者,发生痉挛、意识障碍等中枢神经系统症状的可能性增加。
(7)给药后第3~5天应特别注意观察皮疹等不良反应。出现不良反应时,应采取改用其它药物等适当措施。连续给药时,也应随时观察不良反应。
(8)使用本药前未能确定细菌敏感性时,应在给药开始后第三天确定其对本药是否敏感,然后判断使用本药是否适当。当细菌对本药不敏感时,应立即改用其它药物。
(9)根据病人情况,在不得已的情况下未确定病原菌便开始使用本药时,若数日内病情未见好转,应采取改用其它药物等适当措施。连续给药时,也应随时观察症状好转情况,不得随意长期给药。
(10)根据病人情况需连续给药7天以上时,应明确长期给药的理由,并密切观察是否有皮疹及肝功能异常等不良反应,使用水药不得随意连续给药。
(11)因有时会出现AST(GOT)、ALT(GPT)升高,连续给药一周以上时,应进行肝功能检查。对有肝脏疾病的患者,应注意监测转氨酶和胆红素水平。
2.对实验室检查值的影响
(1)除用试纸检查外,对用班氏试剂、斐林溶液、屎糖试药丸做的尿糖检查,有时出现假阳性,应注意。
(2)直接库姆斯试验有时呈阳性,应注意。
(3)有时尿胆素原检查呈假阳性,应注意。
孕妇及哺乳期妇女用药:
1.尚未确立本药在妊娠期给药的安全性,当判断利大于弊时,才可用于妊娠期或有可能妊娠的妇女。
2.给药期间应避免哺乳。(在动物试验中,发现本药在母乳中有分布。)
儿童用药:
尚未确立本药对低体重儿、新生儿的安全性。
老年用药:
用于老年人时,应注意以下问题并控制剂量及给药间隔,密切观察病人状况,慎重给药。
1.老年人生理功能多下降,发生不良反应的可能性增加。
2.老年人有时因维生素K缺乏而发生出血倾向。
药理毒理:
1.药理
(1)抗菌作用
本药为杀菌剂,抗菌谱极广,并有很强的抗菌活性,对革兰氏阳性菌、革兰氏阴性菌及厌氧菌都很敏感,尤其对包括绿脓杆菌在内的葡萄糖非发酵革兰氏阴性菌有极强的抗菌活性,并且对各种革兰氏阳性和阴性细菌产生的β-内酰胺酶均稳定。本药与其它碳青霉烯类抗生素不同,对人体的肾脱氢肽酶-Ⅰ稳定。
(2)抗菌谱
美罗培南的体外抗菌谱包括绝大部分临床常见的革兰氏阳性、阴性需氧菌及厌氧菌:
革兰氏阳性需氧菌
芽胞杆菌属、白喉棒状杆菌、液化肠球菌、鸟肠球菌、单核细胞增生李斯特氏菌、乳杆菌属、星形诺卡菌、金黄色葡萄球菌(青霉素酶阴性及阳性)。凝固酶阴性的葡萄球菌,包括腐生葡萄球菌、头状葡萄球菌、孔氏葡萄球菌、木糖葡萄球菌、华纳葡萄球菌、人型葡萄球菌、模仿葡萄球菌、中间型葡萄球菌、松鼠葡萄球菌、里昂葡萄球菌。肺炎链球菌(青霉素敏感株及非敏感株)、无乳链球菌、化脓性链球菌、马链球菌、牛链球菌、缓症链球菌、streptococcus mitior、米勒链球菌、血链球菌、草绿色链球菌、唾液链球菌、麻疹孪生球菌、G群链球菌、F群链球菌、马红球菌。
革兰氏阴性需氧菌
木糖氧化无色杆菌、硝酸盐阴性不动杆菌、洛菲不动杆菌、鲍曼不动杆菌、嗜水气单胞菌、温和气单胞菌、豚鼠气单胞菌、粪产碱杆菌、支气管炎博德特氏菌、羊布鲁杆菌、大肠弯曲菌、空肠弯曲菌、弗劳地枸橼酸杆菌、异型枸橼酸杆菌、克氏枸橼酸杆菌、无丙二酸盐枸橼酸杆菌、产气肠杆菌、聚团肠杆菌、阴沟肠杆菌、坂崎肠杆菌、大肠埃杀菌、赫氏埃希菌、阴道加德纳菌、流感嗜血杆菌(包括β-内酰胺酶阳性株和对氨苄青霉素耐药株)、副流感嗜血杆菌、杜克嗜血杆菌、幽门螺杆菌、脑膜炎奈瑟菌、淋病奈瑟菌(包括β-内酰胺酶阳性株、对青霉素和壮观霉素耐药株)、峰房哈夫尼菌、肺炎克雷伯菌、产气克雷伯菌、臭鼻克雷伯菌、产酸克雷伯菌、卡他(布兰汉)莫拉菌、摩氏摩根氏菌、奇异变形杆菌、普通变形杆菌、彭氏变形杆菌、雷氏普罗威登斯菌、斯氏普罗威登斯菌、产碱普罗威登斯菌、多杀巴斯德氏菌、类志贺邻单胞菌、绿脓杆菌、恶臭假单胞菌、产碱假单胞菌、洋葱假单胞菌、荧光假单胞菌、斯假单胞菌、假鼻疽假单胞菌、食醋假单胞菌、沙门氏菌属包括肠炎/伤寒沙门氏菌,粘质沙雷氏菌、液化沙需氏菌、悬钩子沙雷氏菌、宋氏志贺氏菌、福氏志贺氏菌、鲍氏志贺氏菌、痢疾志贺氏菌、霍乱弧菌、副溶血弧菌、创伤弧菌、小肠结肠炎耶尔森氏菌。
厌氧菌
溶齿放线菌、麦氏放线菌、拟杆菌属-普雷沃氏菌属-红棕色单胞菌属、脆弱拟杆菌、变形拟杆菌、多形拟杆菌、侵肺拟杆菌、凝固拟杆菌、单形拟杆菌、吉氏拟杆菌、卵形拟杆菌、埃氏拟杆菌、多毛拟杆菌、bacteroides buccalis、bacteroides corporis、bacteroides gracilis、产黑色普雷沃氏菌、中间素普雷沃氏菌、二路普雷沃氏菌、prevotella splanchnicus、口腔普雷沃氏菌、解糖胨普雷沃氏菌、栖瘤胃普雷沃氏菌、解脲普雷沃氏菌(prevotella ureolyticus)、prevotella oris、颊普雷沃菌、栖牙普雷沃菌、利维普雷沃菌、不解糖红棕色单胞菌、双歧杆菌属、bilophilia wadsworthia、产气荚膜梭菌、双酶梭菌、多枝梭菌、生孢梭菌、尸毒梭菌、索氏梭菌、丁酸梭菌、梭形梭菌、无害芽胞梭菌、近端梭菌、第三梭菌、迟缓真杆菌、产气真杆菌、死亡梭杆菌、坏死梭杆菌、具核梭杆菌、可变梭杆菌、mobiluncus curtisii、mobiluncus mulieris、厌氧消化链球菌、微小消化链球菌、解糖消化链球菌、解糖消化球菌、不解糖消化球菌、大消化链球菌、普氏消化链球菌、疮疱丙酸杆菌、贪婪丙酸杆菌、颗粒丙酸杆菌。嗜麦芽窄食单胞菌(原称嗜麦芽黄单胞菌)、屎肠球菌和对甲氧苯青霉素耐药的葡萄球菌对美罗培南有耐药性。
(3)作用机制
对青霉素结合蛋白(PBPs)有很强的亲和性,阻碍细菌细胞壁(细胞壁肽聚糖的架桥形成)的合成。
2.毒理
(1)急性毒性(LD50,mg/kg)
(2)慢性毒性
对Wister类大鼠按照1~1000mg/kg及对猎狗按照1~500mg/kg实施6个月静脉注射试验,未见有毒性的组织学变化。
(3)生殖毒性
对Wister类大鼠按照120~1000mg/kg及对弥猴按照120~360mg/kg实施静脉注射试验,未发现其对动物的生殖功能有影响,且未见对胚抬、胎仔有致死及致畸形性。
(4)抗原性
列Hartley类豚鼠实施静脉注射试验,全身变态反应和PCA反应为阴性。皮试出现与亚胺培南相同的迟发性反应。以新西兰白类致敏家兔的血清进行的PHA反应试验,检测出低水平的抗美罗培南抗体。
(5)致突变性
在微生物的回复突变试验、致突变性频度试验、使用培养细胞的染色体畸变试验及以小鼠为对象的微核试验中,无致突变性。
(6)肾毒性
对Wister类大鼠按照500mg/kg及1000mg/kg实施的2周静脉注射试验中,与头孢噻肟和头孢他啶1000mg/kg给药组相同,出现轻微的变化,但未见可作为肾毒性指标的变化。
(7)中枢神经系统毒性
使用小鼠脑室给药法研究致惊厥作用的结果如下表所示。
药代动力学:
1.血中浓度
健康成人经30分钟静脉滴注时,血中浓度如下表所示,血浆中浓度依剂量而变动,连续给药时的药代动力学与一次给药时几乎相同,无蓄积性。儿童经30分钟静脉点滴时血浆中浓度,按二室模型,只对清除率假设对数型的个体间差异和个体内差异、分析以体重作为共变量的种族药代动力学的结果如下:全身消除率为0.444L/hr/kg,中央室分布体积为0.291L/kg,周围室分布体积为0.112L/kg,室间的移动清除率为0.160L/hr/kg,全身清除率的个体差异为8.77%CV,血中浓度的个体内残留差异为47.7%CV。
健康成人的药代动力学资料
2.排泄
本药主要从肾脏排泄。无论剂量大小,健康成人经30分钟静脉滴注后,8小时以内的尿中排泄率为60-65%,儿童平均为61%。
3.组织内分布
在痰、肺组织、胆汁、胆囊、腹腔渗出液、脑脊液中的分布良好。
4.肾功能障碍时的血中浓度和尿中排泄
给肾功能障碍的患者0.5g,经30分钟静脉滴注时,其血中浓度如下表所示。肾功能低下时,尿中排泄速度变慢,血中消除时间延长。因此,肾功能障碍的病人使用本药时,需要调整剂量和给药间隔。
贮藏:
密闭,室温(10~30℃)保存。
包装:
西林瓶包装。
0.5g:10瓶/盒。
有效期:
36个月。
执行标准:
进口药品注册标准JX20050151。
进口药品注册证号:H20040666(0.5g)